Nature:西湖大学吴建平/闫浈团队揭示肌营养不良症的结构基础
来源:生物世界 2024-12-15 14:58
研究显示,在dystrophin上占全长不足1/10长度的CR区域是dystrophin参与DGC组装最核心区域。这为设计潜在更合理有效的micro-dystrophin提供了重要参考。
肌营养不良症(Muscular Dystrophy)是一类由遗传因素引起的疾病,表现为进行性肌无力和退化。肌营养不良症有多种亚型,其中杜氏肌营养不良症(Duchenne Muscular Dystrophy,DMD)是最常见且最严重的亚型,也是常见的遗传性神经肌肉病(图1)。DMD通常由肌营养不良蛋白(dystrophin)基因突变引起,该基因位于X染色体上,为X连锁隐性遗传,因此主要影响男性,女性多为携带者,发病率约为1/3500。DMD患者在出生至幼儿期发育正常,3-5岁便开始出现步态异常,随着年龄增长,肌肉逐渐萎缩,需使用轮椅代步,最终通常在20多岁时便因呼吸或心力衰竭而死亡。目前,DMD尚无高效精准的治愈方法。
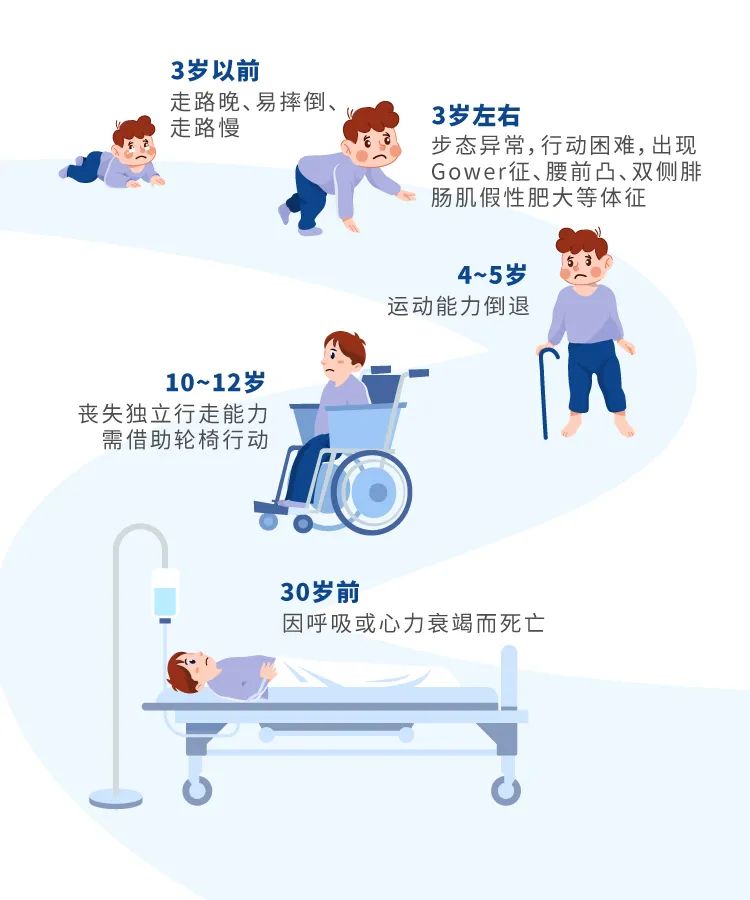
图1. 杜氏肌营养不良临床表现——肌无力和退化
Dystrophin在体内与多个相互作用蛋白形成肌营养不良蛋白糖蛋白复合体(Dystrophin Glycoprotein Complex,简称DGC),主要分布在肌肉组织和神经系统,在维持细胞结构和完整性、参与信号传导、提供机械支持和防止细胞损伤等过程中发挥重要作用。DGC在细胞外侧与细胞外基质相互作用,在细胞内侧通过dystrophin与细胞骨架连接,起到连接细胞内外的桥梁和纽带的作用。
这一特点使得DGC在肌肉收缩过程中能够有效地传递和耗散机械力,进而帮助保护和维持肌肉细胞膜的完整性和稳定性。除了dystrophin突变导致的DMD之外,DGC其他组分的突变还会引起多种肌营养不良症,包括贝氏肌营养不良症(BMD)、肢带型肌营养不良症(LGMD)、先天性肌营养不良症(CMD)等。因此,针对DGC的研究对于深入理解肌营养不良症的发病机制和开发相应的治疗方法具有重要的意义。
2024年12月12日,西湖大学吴建平团队联合闫浈团队在 Nature 期刊发表了题为:Structure and assembly of the dystrophin glycoprotein complex 的研究论文。
该研究首次报道了肌营养不良症的核心关联蛋白——肌营养不良蛋白糖蛋白复合体(Dystrophin Glycoprotein Complex,简称DGC)的高分辨结构,为这一重要复合体的组装、机械传导功能以及与肌营养不良症相关突变的发病机制提供了全新见解。

关于DGC的基础研究以及肌营养不良症的临床研究已经积累了三十多年。尽管如此,DGC复合体的结构研究进展缓慢,仅有个别组分的亚基结构被报道,而完整复合体的全貌一直未知,严重阻碍了对DGC组装和功能的全面理解。鉴于DGC在生理和病理上的重要意义,其完整结构的研究一直是科学家们长期追求的目标。
在最新的这项研究中,吴建平团队和闫浈团队从小鼠骨骼肌组织中分离出了天然内源性DGC复合体,并成功解析了其高分辨率结构,填补了该领域的空白。
这项研究首次呈现了DGC的高分辨率结构(分辨率3.2-3.5 Å),揭示了总共9个蛋白组分,包括四个sarcoglycan(α-、β-、γ-和δ-),dystrophin,dystrobrevin,sarcospan,和两个dystroglycan(α-、β-)(图2)。此外,结构还鉴定了多个糖基化修饰(图2绿色部分)及参与介导蛋白相互作用的脂类分子(图2红色部分)。DGC整体呈现瘦长的结构特征,具有较大的胞外结构域。其中,β-、γ-和δ- sarcoglycans(图2蓝色、黄色、青色部分)三个组分通过β-strand共折叠的方式形成独特的β-螺旋塔状结构(ECD塔)。这一塔状结构就像一个坚实的承重柱牢牢地插在细胞膜上,不仅能够稳定DGC的胞外结构域,而且为另外两个关键蛋白组分α-dystroglycan(也称α-DG, 图2卡其色部分)和α-sarcoglycan(图2粉色部分)提供了支撑位点。这些蛋白组分又共同与dystrophin(图2橙色部分)的CR结构域(cysteine-rich domain)在细胞膜内侧附近形成广泛相互作用,为dystrophin与细胞外的连接提供了结构基础。
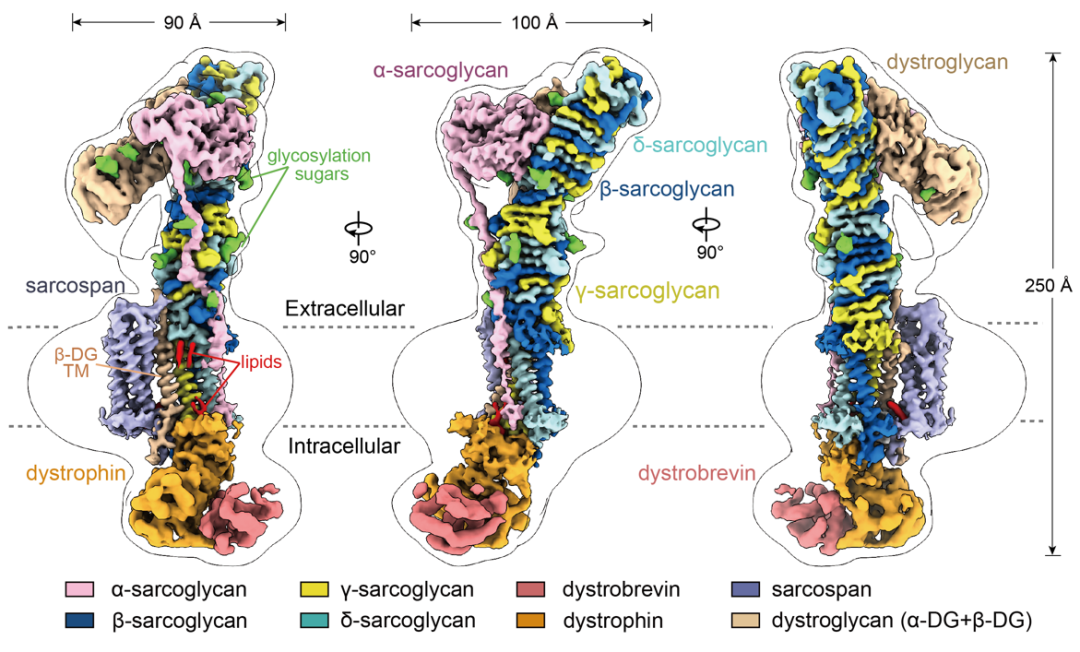
图2. 小鼠骨骼肌内源DGC复合体高分辨结构电子密度图
值得一提的是,该结构在许多方面颠覆了人们先前对DGC组分组装模式的理解(图3)。例如,先前的模型认为α-、β-、γ-和δ-sarcoglycans和sarcospan一起构成了DGC中的一个外围亚复合体。然而,结构显示sarcoglycans和sarcospan并没有直接相互作用,而是分别位于β-dystroglycan(也称β-DG,图3左浅褐色,图3右深褐色部分)跨膜螺旋的两侧,进而帮助稳定β-dystroglycan。这其中由β-、γ-和δ-sarcoglycans形成的胞外侧ECD塔也是首次报道。此外,相比先前认为dystrophin与β-dystroglycan互作的模型,结构揭示了sarcoglycans蛋白在参与dystrophin锚定在细胞膜内侧的过程中发挥了更为关键的作用。
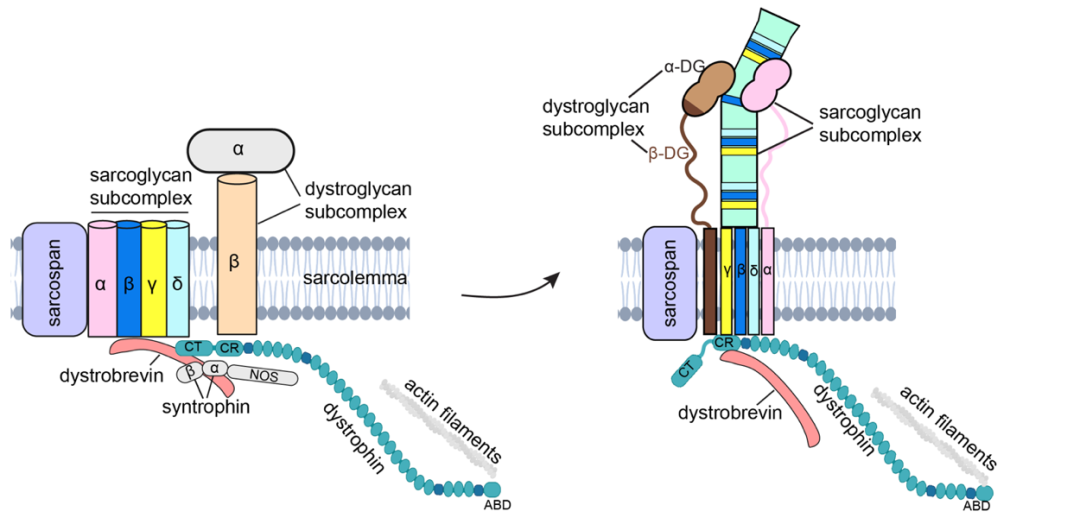
图3. 先前的DGC组装(左)和基于结构研究的DGC组装(右)的卡通模型对比
该结构为过去三十年临床研究中积累的大量与肌营养不良症相关的突变机制提供了宝贵的见解(图4)。研究团队揭示与肌营养不良症相关的致病突变大多分布于三个区域,包括ECD塔、a-sarcoglycan以及dystrophin与其他蛋白的作用界面,这表明这些特定区域对于DGC发挥正常功能的重要作用。研究团队重点分析了临床上引起严重表型的肌营养不良症的突变,发现这些突变往往位于蛋白亚基的相互作用界面和ECD塔的内部(图4c、d),推测这些突变会破坏蛋白质内部的互作或影响蛋白稳定性。为此,研究团队在体外表达了a-sarcoglycan膜外区部分,并在此基础上测试突变体对蛋白表达和性质的影响,发现所有测试的位于a-sarcoglycan上的单点致病突变均会影响蛋白的表达或稳定性,证实上述猜测。这为理解部分肌营养不良症的致病机制提供了深入见解。
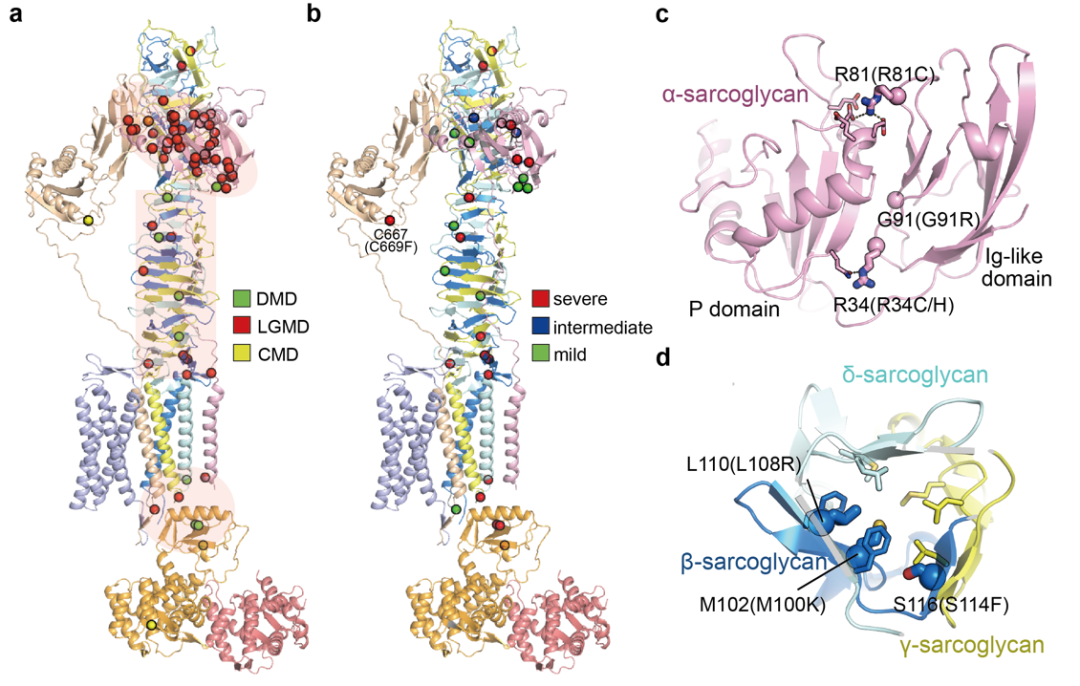
图4. 肌营养不良症相关的突变位点分布及潜在致病机制
此外,该工作为临床开发肌营养不良症的新型基因治疗方法提供重要线索。目前针对DMD患者的治疗手段非常有限,其中一个策略是通过基因治疗方法来修补功能异常的dystrophin蛋白。但是,dystrophin编码基因是人体最长的基因之一,包括内含子在内的基因总长度约有2.2Mb,编码的蛋白则包含了3685个氨基酸。完整递送如此长的基因去替换致病基因,在技术上十分困难。为此,科学家尝试利用简化版的micro-dystrophin来代替全长蛋白。
然而如何选择合适的micro-dystrophin是基因治疗的关键问题。研究团队所解析的结构显示,在dystrophin上占全长不足1/10长度的CR区域(cysteine-rich domain,图2橙色区域)是dystrophin参与DGC组装最核心区域。这为设计潜在更合理有效的micro-dystrophin提供了重要参考。未来,这个结构所提供的重要线索,或许能为肌营养不良症的治疗带来新的希望。
西湖实验室开拓学者万里、清华大学生命科学学院已毕业博士生葛霄飞、西湖大学博士生许祺奎、西湖实验室副研究员黄高兴宇为论文共同第一作者。西湖大学特聘研究员吴建平、闫浈为论文共同通讯作者。美国爱荷华大学Kevin P. Campbell教授和杨天帝博士参与了该工作。西湖大学的冷冻电镜平台、高性能计算中心、质谱平台以及实验动物中心为研究提供了技术支持。该研究获得了国家自然科学基金委、浙江省自然科学基金委、西湖大学和西湖实验室的经费资助。
吴建平博士和闫浈博士在建立独立实验室前曾合作揭示了骨骼肌兴奋收缩偶联通路的关键分子基础(电压门控钙离子通道Cav1.1和钙离子释放通道RyR1的结构研究)。该项目是两位研究员分别建立独立实验室后再次合作,利用结构生物学手段理解肌肉生理功能方面取得的又一重要突破。除此合作方向外,两个团队近年来还分别在生殖生物学和植物蛋白转运方面取得了重要进展。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


